10月30日,我院生物物理团队黄胜友教授在冷冻电镜的核酸结构建模领域取得重要进展,研究成果以“Automated detection and de novo structure modeling of nucleic acids from cryo-EM maps”为题在线发表于《自然·通讯》(NatureCommunications)。华中科技大学为唯一通讯单位,物理学院2022级博士生李涛(2016级本科生)为论文第一作者,2023级博士生曹宏(2019级本科生)、博士生何佳铧(2014级本科生)为共同作者,黄胜友教授为通讯作者。
核酸作为遗传信息的载体,在蛋白质合成、基因调控、免疫调节等许多生命活动中发挥重要作用,确定核酸的三维结构对于理解其功能及相关药物或疫苗开发至关重要。冷冻电镜技术作为生物大分子复合物结构测定的最重要技术之一,目标是获取生物大分子的三维原子模型。由于冷冻电镜技术限制,在中等或近原子分辨率的冷冻电镜密度图中进行结构建模存在巨大挑战。为了解决建模精度不足和自动化的问题,研究人员提出了各种方法来辅助建模。但与蛋白质相比,核酸结构保守性更低,自由度更多,柔性更大,导致核酸区域的分辨率一般比蛋白质更低,所以核酸结构建模一直是冷冻电镜实验与理论研究的难点与重点。

图1. EM2NA自动结构建模方法的工作流程图。
针对这一问题,研究团队在之前研究的基础上,提出了一种新型的基于深度学习的核酸复合物建模算法EM2NA,对蛋白质-核酸复合物密度图中的核酸结构进行自动建模。EM2NA采用两阶段SCUNet网络来检测密度图中的骨架原子。第一阶段用于从复合物密度图中识别核酸信号,第二阶段用于从识别的核酸信号中检测核酸骨架P-C4’-N1/N9的原子信号。其所使用的深度学习网络,结合了用于局部学习的传统残差卷积模块和用于非局部学习的移动窗口自注意力模块,并将这两种模块整合到了多尺度的UNet中预测实现高精度的骨架原子预测。然后,EM2NA基于原子距离进行路径规划搜索,并根据核苷酸3’端-5’端距离约束确定核酸片段取向,利用序列比对算法将目标序列与预测的核苷酸概率对齐后将对应核苷酸的结构模板匹配到骨架上实现全原子建模。最后通过检测碱基互补配对,进一步优化核苷酸类型和侧链原子构象。
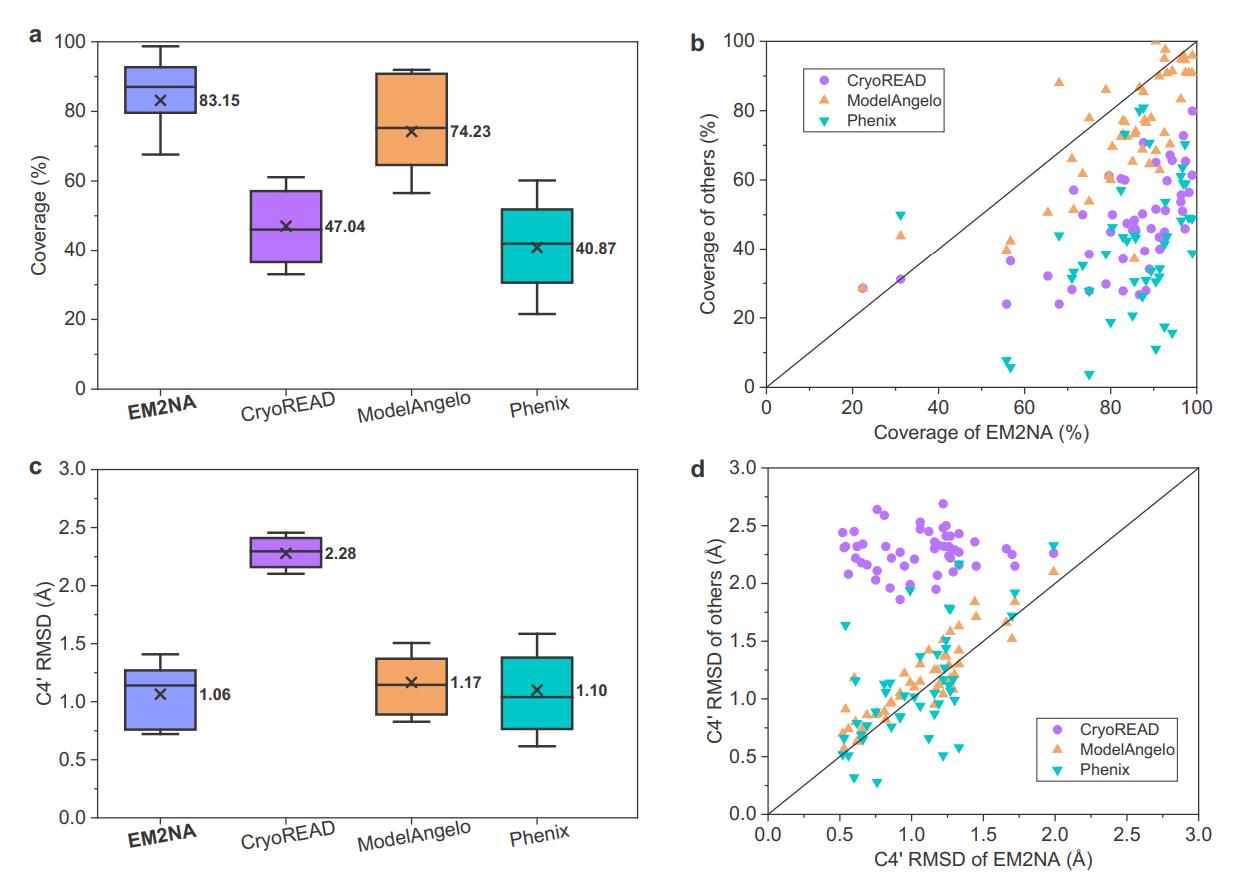
图2. EM2NA在50个蛋白质-核酸复合物电镜图测试集上的表现结果。
EM2NA在包含50个蛋白质-核酸密度图的主测试集中上进行了广泛的评估,并与其它核酸建模算法进行了比较。结果表明,EM2NA显著优于其它核酸结构建模算法,建模出的结构有更高的残基覆盖率,序列匹配率,序列召回率和更低的均方根偏差。EM2NA方法还为263个未建模的密度图构建了原子模型,模型的自评估置信度分数与主测试集分布一致,证明EM2NA在无参考结构的盲测中具有较高的鲁棒性。
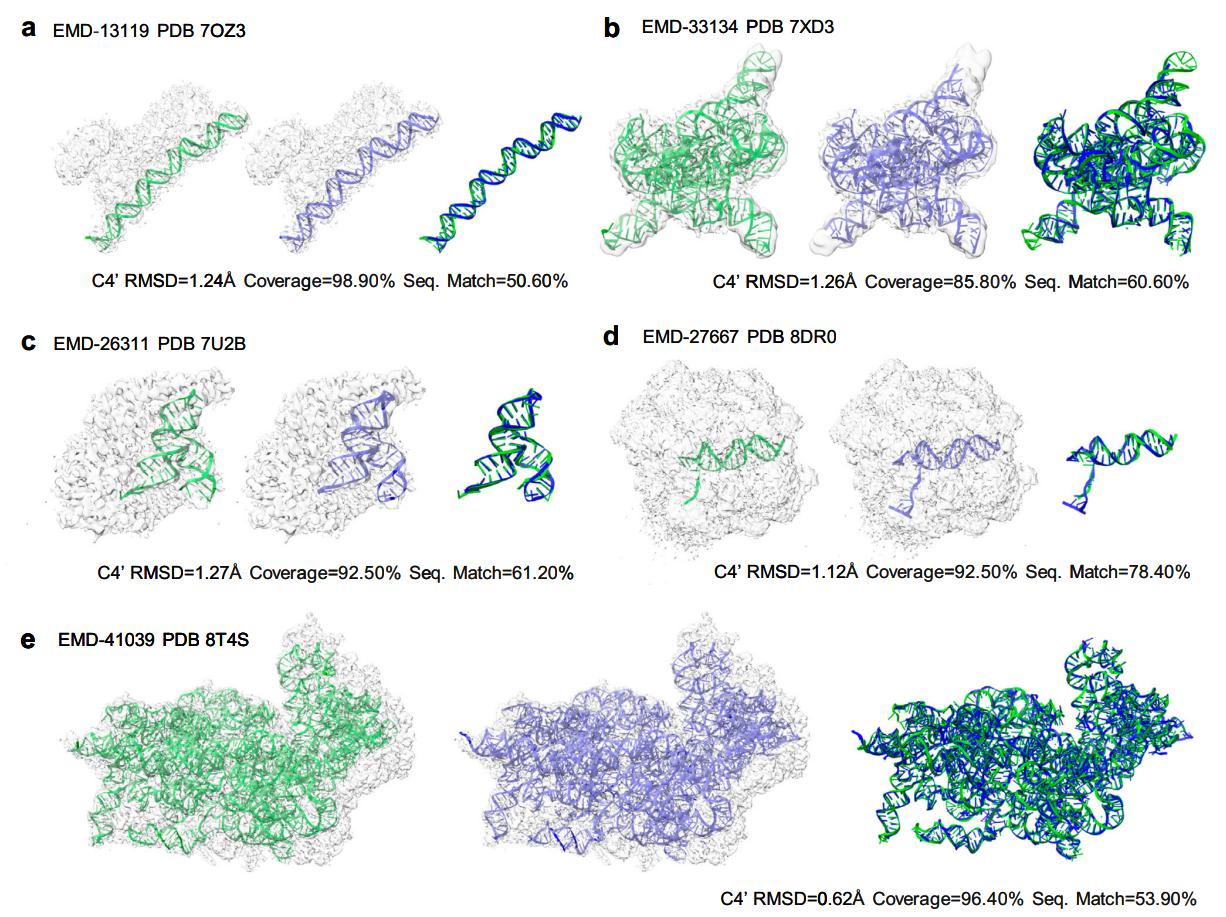
图3. EM2NA构建的小型/大型DNA/RNA结构。
该项研究工作得到了国家自然科学基金(32161133002, 62072199)和华中科技大学人才引进基金的资助。
论文链接:https://www.nature.com/articles/s41467-024-53721-4